Представляем еще одну книгу из научно-популярной серии «Библиотека Гутенберга», которую совместно запустили просветительский проект и издательство АСТ.
Самое важное. Самое полезное. Самое интересное...

Представляем еще одну книгу из научно-популярной серии «Библиотека Гутенберга», которую совместно запустили просветительский проект и издательство АСТ.
Александр Иванов, автор книги «Химия — просто», предлагает читателям познакомиться с историей развития человеческой цивилизации, представленной с точки зрения химии. N + 1 публикует главу из книги Иванова, посвященную открытиям великого российского химика Дмитрия Ивановича Менделеева.
К середине XIX века учёные окончательно поняли, что не смогут искусственно превращать одни элементы в другие. Зато они постоянно открывали всё новые и новые химические элементы, которые надо было хоть как-то систематизировать. Для этого учёными придумывались разные теории о протоводороде, о праматерии и т. д., но все они были неудачными и успеха в научных кругах не имели.
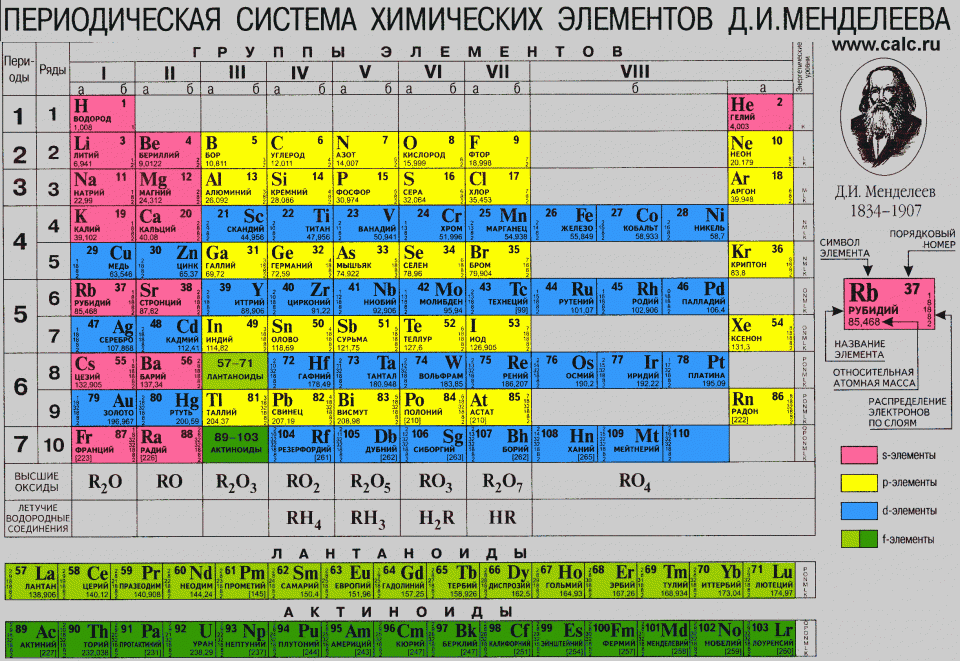
К тому времени, как ты помнишь, атомные веса элементов уже были вычислены. Поэтому, прежде чем мы двинемся дальше, советую тебе взять в руки таблицу Менделеева. Для более наглядного, так сказать, представления о теме разговора.
Итак, в 1817 году немецкий химик Иоганн Дёберейнер открыл, что сходные между собой элементы можно группировать в так называемые триады — группы, состоящие из трёх элементов. Атомный вес среднего члена этой триады был равен среднему арифметическому весу двух крайних элементов. Например, в триаде калий (39,1), рубидий (85,4) и цезий (132,9) среднее значение между калием и цезием составляет 86, что примерно равно весу рубидия.
С тех пор мысль о закономерной зависимости между химическими и физическими свойствами элементов и их атомными весами прочно засела в умах учёных. Многие из них стремились открыть «общий» закон атомных весов, но лишь в 70-х годах XIX века это удалось сделать химикам Д. Ньюлендсу и Л. Мейеру.
В 1864 году Ньюлендс изложил мысль о периодичности атомных весов в Лондонском Королевском обществе. Он заявил: «Если мы расположим все элементы в ряды, по восемь в каждом, по их атомным весам, то убедимся, что через каждые восемь элементов следуют сходные между собой элементы». Данное правило Ньюлендс назвал «законом октав».
Увы, мысль о зависимости атомных весов от других свойств элементов казалась тогда столь неправдоподобной, что председатель Общества обратился к автору с ироническим вопросом: «Не пробовал ли референт разместить элементы в алфавитном порядке?»
Другой немецкий химик Л. Мейер уже несколько лет применял систему элементов, основанную на периодичности их атомных весов, в своих лекциях, но не решался опубликовать её в научных журналах.
Небывалой смелостью в этом вопросе отличился лишь русский учёный-энциклопедист Дмитрий Иванович Менделеев (1834–1907). Он довёл свою периодическую таблицу почти до совершенства и, что ещё интереснее, предсказал ряд фактов, которым суждено было довольно скоро осуществиться. Конечно, поначалу в таблице имелись некоторые недочёты, но Менделеев назвал их следствием неполноты знаний на тот момент.
Дмитрий Менделеев родился в Тобольске, в многодетной семье (он был шестнадцатым по счёту ребёнком). Его отец директорствовал в Тобольской гимназии, и данное обстоятельство отчасти помогло Менделееву, испытывавшему стойкое отвращение к латыни, окончить это учебное заведение. По свидетельству биографа Менделеева, сестра Дмитрия вышла замуж за учителя латыни из той же гимназии, и поговаривали, что благодаря ещё и этому обстоятельству будущий учёный благополучно обошёл все препятствия, связанные с изучением латыни.
Однако вскоре Менделеев встретил более серьёзные препятствия на пути к дальнейшему образованию. Его отец ослеп, ничтожной пенсии не хватало даже на самые необходимые продукты. Дмитрий с матерью переехал к её брату в Москву. Там он должен был поступить в канцелярию губернатора и стать рядовым чиновником, но, несмотря на нехватку средств, стал подумывать о поступлении в Петербургский педагогический институт. Благодаря рекомендации, полученной в школе, без которой в то время в Петербург нечего было и соваться, в институт Дмитрий поступил. Директор института, бывший товарищ отца Менделеева, даже предоставил ему место в общежитии.
По окончании института Менделеев получил должность преподавателя в Симферопольской гимназии. Оттуда переехал в Одессу, но в 1856 году снова вернулся в Петербург, где стал приват-доцентом университета. Три года Дмитрий посвятил разработке нескольких монографий, напечатанию и защите магистерской работы «Об удельных объёмах».
Вскоре он был командирован за границу. В течение двух лет работал в Гейдельберге под руководством учёных Бунзена, Кирхгоффа и Коппа, что оказало заметное влияние на характер его дальнейших работ. Особо значимую роль в жизни Менделеева сыграл съезд немецких естествоиспытателей, состоявшийся в Карлсруэ в 1860 году. Именно на этом съезде молекулярная теория впервые получила всеобщее признание и была официально признана научной.
В 1861 году, по возвращении из заграничной поездки, Менделеев вернулся к обязанностям приват-доцента университета, но уже в 1863 году стал профессором Технологического института. К тому же времени относится выпуск его обширной докторской работы о соединениях спирта с водой и первого издания всем известных «Основ химии». О том, в чём заключалась данная работа и какие опыты для неё проводились, ты можешь узнать на YouTube-канале «Химия — просто», посмотрев видеоролик «Как Менделеев не изобрёл водку». Кстати, возможно, при разработке именно этого сочинения он и открыл свой периодический закон.
В ходе многочисленных опытов Менделеев пришёл к убеждению, что атомный вес является существенным основанием для классификации элементов. В то время было известно всего 64 элемента. (Сейчас, напомню, их число достигло 118.) Составление им периодической таблицы можно сравнить со сборкой сложного паззла, в котором частично не хватало деталей.
Взгляни на таблицу Менделеева. Все известные элементы он разместил в горизонтальных рядах (строках) по их атомным массам. В каждом ряду химические и физические свойства (температуры плавления, атомные объёмы) элементов постепенно меняются. В вертикальных рядах (столбцах) располагаются похожие, как бы родственные элементы. Так, в первой колонке находятся щелочные металлы, которые одинаково реагируют с водой (реакции сопровождаются взрывом).

Периодическая таблица Менделеева 1871 года
Конечно, мы могли бы сейчас рассмотреть множество аналогий в таблице Менделеева, но это потребует углубления в химические основы. Нас же интересует то, какое влияние оказала таблица Менделеева на дальнейшую судьбу химии.
Менделеев считал периодическую систему законом природы. А так как законы природы не допускают никаких отклонений, то любые исключения из этой системы он приписывал несовершенству человеческих знаний: ошибкам в определении атомных масс и незнанию некоторых элементов. И эти его заключения были подтверждены потом действительностью.
Менделеев исправил атомные веса некоторых элементов, но одно исключение оставалось. Вопреки периодической системе атомный вес теллура больше, чем у йода. Также кобальт тяжелее никеля. Хотя все элементы в таблице стояли по возрастанию атомных масс, эти элементы выбивались из закономерности и стояли в обратном порядке.
Также стоит отметить, что в таблице того времени в первой колонке находились инертные газы, которые в настоящее время располагаются в самой последней колонке. С чем это связано? Всё просто. Как я уже сказал выше, раньше элементы в таблице стояли по возрастанию их массы. Логично было предположить, что газы легче других элементов (на то они, собственно, и газы). Однако вскоре мы увидим, что теория о строении атома расширится, и принцип расположения немного изменится. И, тем не менее, он всё равно совпадёт с логикой, вложенной в таблицу Менделеевым.
В настоящее время элементы располагаются в порядке, который соответствует количеству протонов в ядре каждого конкретного элемента. Например, в ядре водорода один протон, поэтому он стоит на первом месте. В ядре атома гелия два протона, поэтому он на втором месте. В ядре же, например, урана — 92 протона, поэтому его порядковый номер в таблице — 92-й. Логично будет предположить, что с увеличением количества протонов в ядре увеличивается и масса каждого следующего элемента. Однако тогда Менделеев ещё не имел представления об устройстве атома, не знал, что у атома есть ядро, состоящее из протонов и нейтронов, а вокруг «вращаются» электроны.
Зато тогда же, во времена Менделеева, самое сильное впечатление на учёных произвело его сбывшееся предсказание новых элементов. Везде, где в таблице оставались пробелы, Менделеев поставил вопросительные знаки. По его мнению, все эти пустые клетки соответствовали новым, ещё не открытым химическим элементам. Кстати, я тоже, когда учился в школе, задавал себе вопрос: как же Менделееву удалось предсказать свойства новых, ещё не открытых элементов? Теперь-то понимаю, что всё довольно просто: атомные веса неизвестных элементов он вычислил при помощи… интерполяции. Помнишь, чуть выше мы говорили про триады, где атомная масса среднего элемента равна среднему значению крайних элементов? Так вот, именно так Менделеев и вычислил атомные массы неизвестных элементов. Их физические и химические свойства он, попросту говоря, предсказал по аналогии с другими, соседними, уже известными элементами той же группы (элементами одного столбца).
Учёные, довольно скоро открывшие целый ряд новых элементов, подтвердили тем самым гениальные предсказания Менделеева. Кстати, многие новые элементы были открыты ими благодаря изобретению спектроскопа — прибора, позволяющего обнаруживать новый элемент даже тогда, когда он содержится в чрезвычайно малом количестве в каком-нибудь соединении. Авторами (изобретателями) спектроскопа стали немецкий физик Г. Кирхгофф и немецкий химик Р. Бунзен.
В 1821 году немецкий физик-оптик Йозеф Фраунгофер изучал солнечный спектр, пропуская солнечный свет через призму. Визуально наблюдение выглядело как радуга, и вдруг Фраунгофер обнаружил, что в его «радуге» присутствуют чёрные линии. Физическое значение этих линий оставалось неизвестным на протяжении долгих 35 лет, пока Г. Кирхгофф не вывел общую теорию явлений поглощения света, положив тем самым начало спектральному анализу.
На основании закона сохранения энергии Кирхгофф пришёл к открытию важного общего закона, который звучит так.
Любое тело в раскалённом состоянии испускает определённые лучи, а именно те, которые оно способно поглощать при этой температуре.
Таким образом, линии Фраунгофера объясняются присутствием в атмосфере солнца некоторых элементов, поглощающих лучи определённой длины волны. Например, водород имеет спектр поглощения, в котором отсутствует красный цвет с длиной волны 656 нанометров.
Когда Бунзен и Кирхгофф определили спектры и других известных элементов и соединений, стало возможным определять химический состав веществ без проведения химических реакций, т. е. определяя только спектр конкретного вещества (данный способ и получил название спектрального анализа). Образно говоря, спектр — это своего рода отпечаток пальца для каждого вещества.
20 сентября 1875 года французский химик-исследователь Лекок де Буабодран открыл новый химический элемент — галлий. Тот самый, что плавится в руках. Свойства этого элемента полностью совпали с предсказаниями Менделеева относительно «экабора» (так называли галлий до его открытия).
И началось. В 1879 году шведский химик Л. Нильсон открыл скандий, а немецкий химик К. Винклер в 1886 году открыл германий. И оба эти элемента тоже прекрасно вписались в периодическую систему Д. И. Менделеева, а их свойства полностью совпали с его предсказаниями.
Сбывшееся пророчество вызвало в учёном мире настоящую сенсацию! Периодическую систему стали перепечатывать и применять во всех странах, имя Менделеева приобрело мировую известность.
Казалось, его периодическая система окончательно установила границы поиска оставшихся новых элементов, которым надлежало заполнить в ней пустующие пробелы. Но действительность подкинула учёным интересную неожиданность: новые элементы были открыты там, где их вовсе не ждали.
Так, считалось, что воздух уже давно и тщательно изучен. Ещё со времён К. Шееле и А. Лавуазье было известно, что «чистый» воздух состоит всего из двух газов — азота и кислорода, — причём на 79 частей азота в нём приходится 21 часть кислорода.
Однако в 1892 году британский физик лорд Рэлей, занимаясь определением плотности атмосферного азота, сделал неожиданное открытие. Все физико-химические измерения он проводил в своей лаборатории с чрезвычайной точностью и вот однажды, сравнивая плотность азота, входящего в состав обычного воздуха, с плотностью азота, полученного искусственным путём, обнаружил, что плотность атмосферного азота равна 2,31, а плотность искусственного — 2,30. Разница вроде бы невелика, но её оказалось достаточно, чтобы побудить Рэлея к дальнейшим исследованиям.
И эти исследования, которые он провёл совместно с шотландским химиком У. Рамзаем, привели к открытию нового газа. Газ этот оказался химически менее активным, нежели азот, к тому же не вступал в соединения ни с какими другими элементами, поэтому его назвали «аргоном» («недеятельный»). Содержание аргона в воздухе составляет менее 1%.
Рэлей и Рамзай тщательно очистили аргон и исследовали его плотность, спектр и другие физические свойства в газообразном состоянии. Почти одновременно с этим профессору К. Ольшевскому из Кракова удалось cжижить аргон и определить его физические свойства в сжиженном состоянии. (Если ты, дорогой мой читатель, хочешь собственными глазами увидеть, как выглядит жидкий и даже твёрдый аргон, то тебе надо просто зайти на YouTube-канал «Химия — просто» и найти видео с названием «Аргон».) Но раз уж был открыт новый химический элемент аргон, значит, следовало найти ему место в периодической системе элементов. Атомный вес аргона составляет 39,9, и, следовательно, логично было бы поместить его между калием и кальцием. Не тут-то вышло! Там для него места не оказалось! Разумеется, тотчас возник закономерный вопрос: что же делать с аргоном, если он не вписывается таблицу Менделеева?!
Сам Д. Менделеев заявил, что надо лишить аргон права считаться элементом, и предложил признать его видоизменённым азотом. Однако гениальное решение в данном вопросе принадлежало У. Рамзаю.
Невозможность размещения нового элемента в общепринятой периодической системе навела Рамзая на мысль, что помимо аргона в природе должны существовать и другие неизвестные газы, сходные с ним по свойствам. Разыскивая соединения аргона с другими элементами, Рамзай занялся исследованием газа, содержащегося в минерале клевеите. Первоначально газ был подвергнут анализу другим учёным — Гиллебрандтом, посчитавшим, что это азот. Рамзай повторил исследование и обнаружил сходство спектра газа из минерала с солнечным спектром. Плотность этого газа была всего в 2 раза больше плотности водорода. Рамзай понял, что имеет дело с новым газом. А поскольку данный газ присутствовал в солнечном спектре, он назвал его «гелием» (от греческого «гелиос» — солнце).
Следовало ожидать, что скоро будут открыты и другие газы, схожие с гелием и аргоном. Однако предпринятые Рамзаем поиски новых газов в минералах, метеоритах и минеральных водах оказались безуспешны. К счастью, примерно в то же время английским инженером Гампсоном была изобретена новая машина для сжижения воздуха. Именно эта машина и помогла открыть новые элементы группы аргона.
Рамзай описывал очередное открытие так: «Желая изучить искусство работы с этим необыкновенным материалом, я попросил у доктора Гампсона один литр жидкого воздуха. Доктор Траверс и я играли им, проводя различные мелкие опыты, чтобы подготовиться к большому опыту, то есть к сжижению аргона. Однако мне жаль было испарить весь запас жидкого воздуха, не подвергнув исследованию остальной части. Ибо, хотя этот искомый газ, вероятно, не мог в ней заключаться, но не представлялось невозможным, что аргон сопровождается более тяжёлым газом. Это предположение подтвердилось».
Так, в той самой малой части воздуха были открыты два новых газа: криптон и ксенон. Из наиболее летучей части воздуха был выделен ещё один газ, более лёгкий, чем аргон, — неон. Таким образом, вопрос об отношении аргона и других инертных газов (гелия, криптона, ксенона и неона) к периодической системе был решён. Поскольку все эти элементы не соединяются с другими элементами, им приписали валентность, равную нулю, и поместили их в нулевую группу — перед щелочными металлами. (В современной таблице нулевая группа отсутствует: инертные газы расположены в самом правом столбце в последней группе в соответствии с их электронной конфигурацией.)
В итоге эти открытия не только не подорвали авторитет периодической системы Менделеева, но и дополнили её, пусть даже совершенно непредсказуемым образом.
Однако вернёмся к Дмитрию Ивановичу. Его научная деятельность в Петербургском университете прервалась неожиданно даже для него самого.
В 1890 году в высших учебных заведениях России начались массовые беспорядки. Особенно сильно студенческие волнения проявились в Петербургском университете. Во время одной своей «сходки» студенты обратились к присутствовавшему на ней профессору Менделееву с просьбой передать министру просвещения их петицию с разного рода требованиями. Менделеев согласился. Однако, как и следовало ожидать, министр его не принял и вдобавок сделал строгое замечание, укорив в том, что тот вмешивается не в свои дела. Из-за возникшего конфликта Менделеев тотчас подал в отставку.
Оставив университет в возрасте 56 лет, Менделеев без дела не остался: по рекомендации министра финансов С. Ю. Витте стал членом «Совета торговли и промышленности».
Последние годы жизни Дмитрий Иванович работал в основанной по его инициативе Палате мер и весов. Помимо проведения основных научных измерений, в задачи этой Палаты входило наблюдение за мерами и весами, а также постепенное введение метрической системы в практическую жизнь.

Дмитрий Иванович Менделеев
К сожалению, большинству наших современников Менделеев известен только своим периодическим законом. А ведь он проводил исследования во многих сферах деятельности! Так, Менделееву принадлежит авторство фундаментальных исследований по физике, метрологии, метеорологии, экономике, трудов по воздухоплаванию, химической технологии, сельскому хозяйству, народному просвещению и многих других работ, тесно связанных с потребностями развития производства в России.
В процессе исследования газов Менделеев вывел общее уравнение состояния идеального газа, которое включало — как частный случай — зависимость состояния газа от температуры, выявленную в 1834 году французским физиком Б. П. Э. Клапейроном. Так, кстати, и появилось известное всем нам со школы уравнение Менделеева — Клапейрона.
Кроме того, именно Менделеев предложил метод дробной перегонки нефти с последующим разделением её на составляющие. Он входил даже в комиссию по рассмотрению спиритических явлений и суеверий, которые были широко распространены в обществе середины XIX века. Работы Менделеева по сопротивлению среды и воздухоплаванию нашли своё продолжение в работах, посвящённых кораблестроению и освоению арктического мореплавания. В 1894 году по просьбе Менделеева был построен бассейн для испытания морских судов с целью создания большого арктического ледокола.
Д. И. Менделеев успел поработать и над улучшением качества используемого в те годы пороха. Одновременно он был выдающимся экономистом, сумевшим грамотно обосновать основные направления развития хозяйства в царской России.
Подводя итог, хочу привести пословицу: «Талантливый человек талантлив во всём». Уверен, что эти слова характеризуют Дмитрия Ивановича Менделеева как нельзя лучше.
Полностью читайте:
Иванов, Александр. Химия — просто. История одной науки. — М.: Издательство АСТ, 2018. — 256 с., [1] с.: ил. — (Библиотека Гутенберга).
Заказать эту книгу можно .
Химик Менделеев после открытия своей знаменитой таблицы стал популярен – настолько, что это его стало раздражать. Вот и на этом званом обеде к нему пристали какие-то барышни вместе с журналистами:
– А правда, что вы сделали своё открытие во сне? Проснулись и записали уже готовую таблицу?
Химик тяжёло вздохнул в ответ – ну что сделаешь с этими легкомысленными людьми? – и ответил:
– Я над ней, может быть, двадцать лет размышлял, а вы думаете – раз и готово…
Навязчивые посетители давно ушли, а пожилой учёный погрузился в воспоминания, машинально поглаживая густую седоватую бороду. Он вспоминал своё детство в Тобольске и долгую поездку в Санкт-Петербург, где получил университетское образование. Но этого молодому хваткому сибиряку было мало, и он, начав карьеру с должности школьного учителя в Симферополе и Одессе, написал диссертацию и стал в 23 года приват-доцентом Санкт-Петербургского университета. А потом были годы исследований – в России и в Европе, обустройство лаборатории с изготовлением нужных Менделееву точнейших приборов, множество экспериментов и тысячи прочитанных книг и статей.
План исследований у молодого учёного был глобален: связать химические свойства элементов с их физическими свойствами, в первую очередь с массой, объёмом и силой взаимодействия атомов. Годы и годы ушли на рассматривание и анализ карточек, на которых были записаны свойства известных элементов. Никакой сон не помог бы, если бы не было этих долгих лет…
Проблема классификации химических элементов по свойствам и весу атомов заключалась в том, что далеко не все химические элементы в то время были открыты, а для тех элементов, что были открыты, физические параметры нередко определялись с большой ошибкой. И молодому учёному нужно было сначала уловить скрытый ритм химических свойств элементов, а потом понять – если какие-то элементы не укладываются в найденную закономерность, то является ли это признаком ошибочности данной закономерности или признаком неправильно определённых свойств химических элементов?
Гениальность и смелость Дмитрия Ивановича Менделеева, достигшего к 1869 году, времени открытия своего Периодического закона, 35-летнего возраста, как раз в том и выразились, что он верно уловил гармонию в периодичности химических свойств элементов, а параметры тех элементов, которые ей не соответствовали, он смело исправил. Для этого нужно твёрдо верить в открытый закон! Например, в те времена атомный вес урана считался равным 120 единицам.

– А что такое единица атомного веса? – спросил Андрей.
– Это одна двенадцатая массы атома углерода. Так как ядро углерода имеет массу 12 и состоит из шести протонов и шести нейтронов, то получается, что за единицу принимается величина, близкая к массе одного нуклона в ядре, то есть протона или нейтрона. Возвращаясь к урану: Менделеев взял и увеличил его массу со 120 до 240 единиц! Впоследствии оказалось, что уран имеет среднюю массу в 238.
– То есть Менделеев, исходивший из теоретических соображений, оказался гораздо точнее, чем все экспериментаторы? – удивился Андрей.
– Да, хорошая теория должна обладать способностью к верным предсказаниям. Учёный исправил параметры девяти элементов: например, известную атомную массу тория учёный изменил с 174 до 231; массу индия исправил с 75,6 на 113,4; массу церия поднял с 92 до 140. Все эти и ряд других сдвигов в параметрах элементов потом полностью подтвердились. Более того – таблица Менделеева позволила не только правильно разместить известные элементы, она также указала на пропуски или пустые клетки в таблице.
– А в этих пустых клетках должны были находиться ещё не открытые элементы? – догадалась Галатея.
– Верно. На основе открытых периодичностей свойств химических элементов Менделеев детально описывал возможные характеристики ещё не открытых элементов, указывал их атомный вес и химические свойства.
Учёный писал: «Без Периодического закона мы не имели никаких поводов предсказывать свойства неизвестных элементов, даже не могли судить о недостатке или отсутствии тех или других из них. Открытие элементов было делом одного наблюдения… Закон периодичности открывает в этом последнем отношении новый путь».
Базируясь на своём законе периодичности, Менделеев предсказал наличие десяти ещё не открытых химических элементов: скандия, галлия, германия, гафния, полония, астата, технеция, протактиния, рения и франция. Все они были впоследствии открыты, что стало настоящим триумфом Периодического закона Менделеева.
Дзинтара раздала детям красивые цветные листки с таблицей.
– Возьмите таблицу Менделеева и внимательно посмотрите на неё. Она рекордсмен по информационной ёмкости: эта таблица, умещающаяся на одной странице, рассказывает невообразимо много о тайнах нашего мира. Таблицу Менделеева, как и физическую карту Земли, можно рассматривать бесконечно долго.
– Мама, а почему химические элементы проявляют такую периодичность? – спросила Галатея.
Дзинтара призадумалась, а потом молча потянулась к вазе, заполненной разными ягодами, и стала что-то сортировать.
Вскоре на столе выросли три кучки: тёмно-красных вишен, полупрозрачного желтоватого винограда и ягод чёрной смородины.
– С помощью этих ягод мы сейчас смоделируем набор элементов, из которых создан наш материальный мир. Пусть вишни означают протоны, виноградинки – нейтроны, а мелкие ягоды смородины – электроны.
Дзинтара взяла прозрачные стаканы и расставила их в ряд. В первый стакан она бросила одну вишенку, во второй – две, в третий – три.
– Каждый стакан – это ядро какого-то химического элемента. В таблице Менделеева больше сотни элементов, но мы не будем брать сотню стаканов – ведь нам важно понять общий принцип строения ядер химических элементов. В каждый следующий стакан мы кладём на одну вишенку больше, так что количество вишенок в стакане будет означать его порядковый номер в общем ряду.
– Значит, заряд каждого элемента будет всё время нарастать! – сказал Андрей.
– Верно, – согласилась Дзинтара. – Электрический заряд ядра каждого элемента, измеренный в зарядах протона, который равен заряду электрона, строго равен порядковому номеру элемента в таблице Менделеева – и растёт вместе с ним. Масса ядра тоже увеличивается с порядковым номером, но по более сложной функции.
Дело в том, что все протоны заряжены положительно и отталкиваются друг от друга. Чтобы склеить их вместе, нужны нейтроны – частицы, очень похожие на протоны, но не обладающие электрическим зарядом. Протоны и нейтроны притягиваются друг к другу за счет мощных сил, которые так и называют – ядерными. Нейтроны нужны, чтобы «сцементировать» атомные ядра. Нейтроны склеиваются с протонами ядерными силами – и делают ядро стабильным, не радиоактивным.
Дзинтара указала на стакан с одинокой вишенкой.
– Этот единственный протон – ядро водорода, он стабилен и не нуждается в поддержке нейтроном. Зато если у этого элемента, гелия, – Дзинтара указала на следующий стакан с парой вишен, – составить ядро всего из двух протонов, то оно окажется очень нестабильным. Если мы добавим в ядро гелия один нейтрон, – Дзинтара бросила в стакан виноградинку, – то получим стабильный изотоп гелия – гелий-3. Если добавить ещё один нейтрон, то получится отличное, очень крепкое ядро гелия-4, которое настолько прочно, что может рассматриваться как отдельная элементарная частица – альфа-частица, – ведь именно она вылетает из многих радиоактивных ядер.
– А что будет, если к вишнёвому ядру водорода добавить виноградный нейтрон? – Галатея указала пальцем на стакан с одной вишней.
– Мы получим тяжёлый водород – дейтерий, который будет стабильным. Присоединение второго нейтрона дает тритий – сверхтяжёлый и нестабильный водород, с периодом полураспада двенадцать лет.
Но давайте обсудим третий элемент – литий, в состав ядра атома которого входят три протона. Чтобы ядро лития стало стабильным, нам нужно добавить ему три или четыре нейтрона. Ядра, которые содержат одинаковое количество протонов, принадлежат одному химическому элементу, но если у них разное число нейтронов, то говорят, что элемент имеет несколько изотопов. Поэтому литий с тремя протонами имеет два стабильных изотопа – с тремя и четырьмя нейтронами.
Дзинтара бросила в стакан три виноградинки, а потом – ещё одну.
– Для стабильности ядра требуется нейтронов больше, чем количество протонов, или, как минимум, столько же – это правило неукоснительно выполняется во всей таблице Менделеева, за исключением водорода.
Четырёхпротонное ядро бериллия нуждается для стабильности в пяти нейтронах, а пятипротонное ядро бора содержит пять или шесть нейтронов. Три следующих важнейших для жизни элемента: углерод, азот и кислород – достигают стабильности при минимальном количестве нейтронов, равном числу протонов, но сохраняют стабильность и при увеличении числа нейтронов на единицу или даже на двойку, как в случае кислорода. С ростом заряда ядра избыток числа нейтронов над числом протонов нарастает.
– Ведь протоны отталкиваются друг от друга, а нейтроны нет – так что чем их больше, тем ядру легче сохранять свою стабильность, – авторитетно заявил Андрей.
– Прочность ядер нарастает вместе с массой и достигает максимума на ядре железа. Потом ядерная прочность начинает падать – и после последнего стабильного ядра свинца с номером 82, в котором находится 82 протона и 125 нейтронов, уже никакая комбинация из нейтронов и протонов не может обеспечить устойчивость ядра.
– А какой номер клетки у радиоактивного урана? – спросила Галатея.
– Ядро урана содержит 92 протона и почти полтораста нейтронов.
Тут Андрея осенило:
– Теперь я понимаю, почему атомные электростанции производят так много радиоактивных отходов! Ядро урана с большим количеством нейтронов, поделившись пополам, дает два ядра из середины таблицы Менделеева, которым не нужно такое количество нейтронов! Радиоактивность таких новых ядер будет огромной!
– Ты сообразил быстрее меня, – признала Дзинтара. – В целом ядра химических элементов являются довольно простыми и прочными сгустками из протонов и нейтронов. Зато эти ядра служат основой для возникновения атомов, которые включают в себя электроны и оказываются гораздо более сложными конструкциями.
– Действительно, ядра атомов имеют положительный электрический заряд – значит, они должны притягивать к себе электроны везде, где только встретят их, – сказал Андрей.
– Верно, – согласилась Дзинтара. – Ядра химических элементов крайне редко можно встретить голыми, без электронов. В нормальных условиях атомы обычно содержат столько электронов, чтобы полностью компенсировать заряд ядра.
– Это значит, что в нейтральном атоме столько же электронов, сколько протонов в его ядре. А это число равно номеру химического элемента! – выпалила Галатея.
– Молодец! – сказала Дзинтара. – Ты хорошо разобралась. Это означает, что вокруг атома, например, свинца размещаются 82 электрона. Но, притягиваясь к ядру, они одновременно отталкиваются друг от друга, поэтому устойчивое размещение отрицательных электронов вокруг положительных ядер оказывается очень непростой задачей.
Дзинтара положила возле стакана с одной вишенкой одну ягодку смородины, а возле стакана с двумя вишенками и двумя виноградинками – две смородинки.
– Это модели атома водорода с одним электроном и атома гелия с двумя. Учёные знают, что эти элементы весьма различны по химическим свойствам: в ходе некоторых реакций у водорода можно отнять его собственный электрон, а можно присоединить к нему лишний. Например, при горении водорода в кислороде образуется вода с молекулой, состоящей из двух атомов водорода и атома кислорода. В молекуле воды кислород отнимает у атомов водорода по электрону, присоединяя их к своей электронной свите. Но и ядра водорода он не отпускает – ведь они заряжены положительно и притягиваются к отрицательно заряженному кислороду, получившему избыток электронов, – именно так и получается прочная молекула воды.
Зато у гелия очень трудно что-либо отнять – это такой скряга, который не хочет расставаться со своими электронами. Впрочем, и чужих электронов ему не надо. Это свойство гелия обеспечивает ему почти идеальную химическую инертность. Его так и называют: инертный газ, что значит – неповоротливый, не реагирующий ни на что.
В таблице Менделеева выделяют восемь групп элементов, которые проявляют периодичность. А знаете, почему их восемь? Потому что вокруг атомных ядер известно восемь уровней, где могут располагаться электроны. На первом уровне могут размещаться только два электрона…
Дзинтара нарисовала возле каждого из стаканов что-то вроде деревьев с восемью длинными ветками.
– Электроны водорода и гелия – это электроны первого уровня. Больше чем два электрона на первой или нижней ветке не поместятся. Поэтому, когда к ядру лития присоединяются три электрона, два из них садятся на самый низкой уровень, а третьему приходится помещаться на ветке повыше – на втором уровне.
Дзинтара нужным образом разместила три ягоды смородины возле стакана, где лежало три вишни и четыре виноградинки. Дети смотрели на её ловкие руки, которые сортировали ягоды, и переводили глаза на карточки с таблицей Менделеева, где в каждой клетке, соответствующей отдельному химическому элементу, указывалось размещение электронов по разным орбитам вокруг ядра данного элемента.
– На втором уровне могут уместиться восемь электронов. Поэтому следующие за литием семь атомов размещают свои электроны именно на этом, втором уровне: бериллий, бор, углерод, азот, кислород, фтор, неон. Последние три элемента особенно интересны: кислороду для заполнения второго уровня не хватает двух электронов, фтору – одного, а неон полностью заполнил второй уровень электронами. Эти особенности строения электронных оболочек определяют химические свойства данных элементов: кислород и фтор стремятся отобрать недостающие им электроны у любых встреченных ими атомов, заодно присоединить и сами эти атомы, «окислить» их, образовав молекулу «оксида» с одним атомом кислорода или «диоксида» – с двумя. Кислород – это самый распространённый окислитель, поэтому процесс окисления даже назвали по его имени.
– Может, это его назвали по процессу окисления? – предположила Галатея. – А нельзя ли привести какой-нибудь пример этого… окисления?
Дзинтара ответила:
– Конечно. Окисление железа, или образование ржавчины, является самым типичным примером соединения кислорода с металлом. Следующий элемент таблицы Менделеева, фтор, является самым сильным окислителем в природе, который может окислить все химические элементы, включая золото и платину. Исключением являются гелий и неон – инертность этих газов не может преодолеть даже агрессивный фтор.
Углерод имеет на втором электронном уровне четыре электрона, то есть можно с одинаковым основанием сказать, что его второй уровень наполовину пуст или наполовину полон. Эта особенность углерода позволяет ему создавать самые различные химические соединения, например отдавая сильному окислителю все четыре электрона – как в случае углекислого газа CO2, или отнимая у четырёх атомов водорода по электрону, образуя метан CH4. Это обилие химических соединений углерода сделало его основой жизни на нашей планете.
– А на других планетах? – полюбопытствовала Галатея.
– Вероятнее всего – и на других планетах, хотя некоторые фантасты рассуждают о возможности жизни не на основе углерода, а на основе других химических элементов. Но вряд ли такие формы жизни возможны.
– А почему так важно подсчитывать электроны на разных оболочках? – спросила Галатея.
– Давайте посмотрим на трёх соседей по таблице Менделеева – углерод, азот и кислород: массы их ядер очень близки, а их электрические заряды, то есть число протонов, отличаются всего на единицу. Но за счет другого расположения электронов мы получили совершенно разные по химическим свойствам элементы: углерод, который представляет собой твердое тело, и два газа с очень различными свойствами: слабо реагирующий с окружающим азот или кислород – сильнейший газ-окислитель.
Сотня химических элементов, ядра которых плавно меняют свои заряды и массы, благодаря разному строению электронных оболочек, скачками меняют свои свойства. Поэтому, если не разобраться со строением электронных оболочек атомов, то нельзя понять их способность к химическим реакциям. Именно электроны дают возможность сотне химических элементов соединяться в миллионы различных видов молекул, из которых построено всё вокруг нас, а также сконструированы мы сами. Химия – это фактически электрическая наука, которая базируется на движениях электронов и зарядов.
Менделеев открыл периодичность химических свойств элементов, глубокая причина которой заключается в том, что когда атомы начинают заполнять электронами новый уровень, то их химические свойства становятся очень похожими на свойства элементов с электронами на предыдущем уровне. Вот щелочной металл натрий, который настолько активно ищет, кому бы отдать свой единственный электрон на третьем уровне, что при падении в воду начинает с шипением расщеплять её, выдавливая из неё водород и присоединяя остаток к себе, образуя едкую щёлочь. Его химические свойства аналогичны свойствам других щелочных металлов – лития с одним электроном на второй оболочке и калия с одним электроном на четвёртой оболочке.
Хлор, которому не хватает для заполнения третьей оболочки всего одного электрона, является аналогом агрессивного фтора, а газ аргон, полностью укомплектовавший третий уровень электронами, является, как и неон, представителем инертных газов.
Но заполнение электронами четвёртой оболочки оборачивается сюрпризом: если кальций, следующий за щелочным калием, смог разместить на четвёртом уровне пару электронов, то следующий элемент – скандий – уже не смог разместить на внешнем уровне третий электрон. Новый электрон, притянутый выросшим зарядом ядра скандия, не удержался на растянутой четвёртой оболочке и провалился ниже – на третий уровень, потеснив восьмёрку тамошних электронов и став девятым на этой оболочке. Аналогичная ситуация произошла с электронами и последующих химических элементов. Так началось химически близкое семейство из десяти металлов: скандия, титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди и цинка.
– А почему они оказались химически близкими, хотя заряд ядра у них нарастает? – спросил Андрей, держа в руках таблицу Менделеева и внимательно рассматривая её.
– Потому что на химические свойства элемента, главным образом, влияет количество электронов на внешней оболочке – и у всех этих металлов на внешней, четвёртой оболочке расположено только по два электрона, за исключением хрома и меди, у которых уцелело на внешней оболочке вообще по одному электрону. Остальные электроны провалились на третий уровень, увеличив – к цинку – количество здешних электронов до 18-ти. Это число исчерпало возможности третьего уровня, и последующие электроны снова размещаются на четвёртом уровне – у галлия их там три, у германия – четыре. Эти изменения на самом внешнем электронном уровне снова начинают активно менять химические свойства элементов, причем восстанавливается аналогия с элементами предыдущей группы: бром, у которого не хватает одного электрона, близок по активности к хлору, а криптон с восьмёркой электронов на четвёртом уровне оказывается инертным газом, как и неон.
Двигаясь дальше по таблице Менделеева – а это очень увлекательное путешествие! – мы увидим периодичность свойств в новых группах элементов.
Как уже говорилось, всего в таблице Менделеева выделяется восемь групп элементов с химической периодичностью. В пятой группе снова появляется группа металлов, которые удерживают на внешней, пятой оболочке только один или два электрона – а остальные проваливаются на четвёртую. В этой группе металлов, которая начинается с иттрия и заканчивается кадмием, есть хорошо известные молибден, палладий и серебро. В шестой группе серия металлов начинается с лантана и заканчивается ртутью, но здесь насчитывается уже не десять, а 24 металла, включая 14 металлов-лантанидов.
– И сколько же электронов они удерживают на внешней, шестой оболочке? – спросил Андрей.
– По-прежнему по одному или два, – ответила Дзинтара. – Но, в отличие от предыдущих групп металлов, у которых электроны проваливались ниже на один уровень, у лантанидов электроны стали проваливаться на два уровня ниже, увеличивая количество электронов на четвёртом уровне с 18 до 32.
– Ага, у десяти обычных металлов электроны провалились на один уровень, а у 14 лантанидов – на два. Но это значит, что химические свойства лантанидов должны быть очень похожи, если они отличаются лишь количеством электронов на третьей сверху оболочке! – заключил Андрей.
– Совершенно верно! – похвалила сына Дзинтара, а Галатея недовольно посмотрела на Андрея. – Химические свойства лантанидов, которые называют ещё «редкими землями», очень близки друг к другу.
Среди обычных металлов шестой группы есть такие известные, как вольфрам, платина и золото.
В седьмой группе заполнение электронных оболочек идет по тому же принципу: группа начинается с радиоактивного щелочного металла франция, который был предсказан Менделеевым на основании его таблицы и открыт несколько десятилетий спустя. У франция есть электроны на семи оболочках: 2 электрона – на первой, 8 – на второй, 18 – на третьей, 32 – на четвёртой, 18 – на пятой, 8 – на шестой, 1 – на седьмой.
Следующий элемент номер 88 – радий – удерживает второй электрон на седьмой оболочке, зато у актиния за номером 89 новый электрон проваливается на шестую оболочку.
За актинием следует группа из 14 актиноидов. У тория за номером 90 новый электрон тоже садится на шестой уровень, увеличивая там количество электронов до десяти. У протактиния с номером 91 новый электрон ухает сразу на пятый уровень, захватывая с собой ещё и электрон с шестого уровня. В группе актиноидов пятый уровень достраивается с 18 до 32 электронов. Она включает такие известные радиоактивные металлы, как уран и плутоний.
Обычные металлы седьмой группы, такие как резерфордий с номером 104 или рентгений 111, не встречаются в природе – их синтезируют на ускорителях в ничтожных количествах.
Как установил Менделеев, все периодические группы химических элементов начинаются со щелочных металлов, за исключением первой, которая начинается с водорода.
– Но, может быть, можно рассмотреть водород как самый лёгкий щелочной металл? – спросил Андрей.
– Рассмотреть-то можно… Но даже если пренебречь фактом, что в нормальных условиях водород – газ, то очевидно, что водород не обладает главным свойством щелочных металлов: вытеснять из воды водород и образовывать щёлочь. Ведь водороду в данном случае придётся вытеснять самого себя!
– Чего никто не заметит! – победно сказала Галатея и почему-то показала Андрею язык.
– Все периодические группы заканчиваются инертными газами, за исключением восьмой, до конца которой учёные ещё не добрались, поэтому тамошний инертный газ, который должен быть сильнорадиоактивным, науке ещё неизвестен.
– Интересный газ – химически инертный и ядерно нестабильный! – пробормотал Андрей.
– Именно таким газом является радиоактивный, но химически инертный радон, замыкающий шестую группу элементов.
– А почему электроны себя так ведут – заполняют то одну, то другую оболочку? – спросила Галатея.
– Их поведение обусловлено электрическим притяжением ядра с одновременным отталкиванием со стороны других электронов. Важно учитывать квантовое поведение частиц, потому что электроны – это не столько частицы, сколько волны.
Гениальность Менделеева заключается в том, что он открыл основные квантовые закономерности формирования электронных оболочек атомов за 65 лет до создания квантовой механики, задолго до введения квантов Планком и создания реалистичной атомной модели Бора – Резерфорда.
Менделеев расположил элементы в порядке возрастания атомного веса и уловил глубинную симметрию – периодичность их химических свойств! Сейчас мы выводим квантовую основу всей таблицы Менделеева на нескольких страничках учебника, но тогда… Это и есть то, что называют гениальным открытием.

Сейчас мы понимаем, что десятки электронных волн сталкиваются и переплетаются вокруг атомного ядра, порождая самые замысловатые электрические конфигурации. Именно ими занимается квантовая механика, рассчитывающая с помощью сложных уравнений и мощных компьютеров поведение многоэлектронных оболочек атомов; именно эти электронные оболочки определяют химические свойства элементов, из которых состоим мы сами, наша еда и наше окружение.
– То есть вкус нашей еды зависит от электронных облачков вокруг атомов? Значит, мы едим электрическую еду? – спросила Галатея.
– Верно. Мы все фактически являемся электрическими организмами – мы используем электричество для передачи сигналов по нашим нервам, а для поддержания сил мы едим еду, приправленную электронами. Некоторые организмы, вроде электрических угрей, используют электроток ещё и как оружие, а кое-кто научился есть электричество впрямую, без всякой сопутствующей еды.
– Кто-то научился питаться электричеством прямо из розетки? – удивлённо спросил Андрей.
– Да, есть организмы, которые питаются электричеством, или, попросту, электронами, напрямую. Если взять маленький аккумулятор, прийти на берег реки и воткнуть электрод в илистое дно, то вокруг него соберутся совершенно особые бактерии, которые питаются электричеством. Этим одноклеточным организмам, которые живут на дне морей и в речном иле, не нужно есть и дышать – они способны просто поглощать электроны. Но электроны должны будут куда-то течь и сбрасываться, поэтому бактерии находят способ избавлятся от ненужных электронов, выделяя их наружу.
– Ты хочешь сказать, что есть бактерии, которые едят электроны и какают ими? – недоверчиво спросила Галатея.
– Да. Эти бактерии слизывают электроны с поверхности электрода, а потом сбрасывают их в окружающие металлы или по проводам передают соседям…
– По проводам? – не поверила своим розовым ушкам Галатея.
– Эти бактерии выращивают из себя тонкие белковые нити, которые хорошо проводят электричество. Микроорганизмы соединяются этими проводами друг с другом в электрический контур, образуя длиннющие, в несколько сантиметров, электрические цепи. Такая бактериальная цепь может, например, соединять два участка почвы с разными химическими свойствами – и это позволяет бактериям эффективно использовать эту разницу.
Вольта соединил медный и цинковый кружок слабым раствором кислоты и получил электрический элемент. Что-то похожее делают и бактерии, образуя бактериальную электрическую батарею. Часто в такой электрический симбиоз вступают разного вида одноклеточные организмы – они делят свои функции и, передавая друг другу электроны, выживают успешнее, чем в одиночку.
Человек ничем принципиально не отличается от этих электробактерий. Мы едим электрические атомы, мы впитываем с едой электроны и выдыхаем их из лёгких, присоединяя к кислороду. Вся сложная цепь химических превращений еды и кислорода в нашем организме фактически сводится к тому, что мы питаемся электрической энергией.
– Постой, мама! – воскликнул Андрей. – Я привык думать, что сам кислород необходим нашему организму, а ты говоришь, что он всего лишь уносит от нас электроны.
– Конечно, ведь мы, вдыхая кислород, не усваиваем его, а, соединив с углеродом, выдыхаем его примерно в том же количестве, в каком получили при вдохе. И если человек не может дышать, то умирает за несколько минут из-за переизбытка электронов, которые не могут больше уходить наружу.
– А как же вкусные вещи, которые мы едим, тот же сахар – он тоже всего лишь передатчик, вернее, источник электронов? – стала расспрашивать Галатея.
– Да, у сахара есть избыточные электроны, наши клетки расщепляют сахар, и электроны проходят сквозь клетки до тех пор, пока не присоединятся к кислороду, который, как мы знаем, очень охотно присоединяет к себе электроны. В ходе расщепления сахара и перемещения электронов наши клетки вырабатывают аденозинтрифосфат – молекулу, которая служит батарейкой практически во всех живых организмах. Без движения электронов наша жизнь была бы невозможна.
– Кругом одно электричество! – с удивлением сказала Галатея.
– Астробиологи очень заинтересовались земными электробактериями. Ведь в Солнечной системе есть места, где мало света, кислорода и органических соединений. Могут ли там жить бактерии, которые питаются электричеством и не нуждаются в кислороде? Электробактериями активно занимаются и земные экологи – они рассчитывают, что те, способные жить в самых грязных и даже радиоактивных местах, могут помочь с очисткой нашей планеты от опасных загрязнений. Вот так электричество теснейшим образом переплетается с химией и биологией.
– Буду изучать электрохимию и особенно электробиологию! – решила Галатея.
Примечания для любопытных
Дмитрий Иванович Менделеев (1834–1907) – великий русский химик, открыватель Периодического закона химических элементов – фундаментального закона природы. Элемент 101 назван в его честь – менделеевий.
Франций – радиоактивный щелочной металл, предсказанный Менделеевым и открытый в 1939 году Маргаритой Перей, сотрудницей Института радия в Париже. Чрезвычайно редкий химический элемент: суммарное количество франция в земной коре оценивается в 340 граммов. (Информацию обо всех остальных химических элементах легко можно найти в учебниках химии или Интернете.)
Макс Планк (1858–1947) – великий немецкий физик, основоположник квантовой физики. Ввёл понятие «квант». Лауреат Нобелевской премии (1918). Именем Планка названа фундаментальная константа квантовой теории – «постоянная Планка».
Эрнст Резерфорд (1871–1937) – великий физик новозеландского происхождения. Предложил планетарную модель атома в виде положительного маленького ядра, вокруг которого двигаются электроны. Лауреат Нобелевской премии (1908).
Нильс Бор (1885–1962) – великий датский физик, ученик Резерфорда. Создатель первой квантовой модели атома и его электронных оболочек. Лауреат Нобелевской премии (1922).
© 2009 Технополис завтра
Перепечатка материалов приветствуется, при этом гиперссылка на статью или на главную страницу сайта "Технополис завтра" обязательна. Если же Ваши правила строже этих, пожалуйста, пользуйтесь при перепечатке Вашими же правилами.